1. ¿Para que sirve la tabla periódica?
2. ¿Qué criterios usaron para construirla?
3. ¿Cómo varían las propiedades?
4. ¿De donde proceden estos nombres?
Francio, Galio, Oro, Plata, Sodio, platino, hierro, polonio y paladio
RESPUESTAS DEL EXAMEN DE LA TABLA PERIÓDICA.
1. Para clasificar y organizar los elementos químicos.
2. Los criterios que utilizaron fueron si los elementos eran metales o si eran de familia como, la familia del escandio o del titanio.
3. Depende de cada elemento, de sus propiedades y de que efectos causen.
4. Francio (Fr): se lo puso la francesa Marguerite Perey en honor a su patria.
Galio (Ga): por Gallium, de la Galia, debido a la patria del químico que lo
descubrió. Posible ingrediente secreto de la poción de Panoramix
Oro: El símbolo Au viene del latín 'aurum'. Es un metal de color amarillo,
blando y maleable, muy resistente a la acción química de los oxidantes.
Plata: La plata tomó nombre del adjetivo plattus, del latín medieval, ancho,
aplanado. Se utilizó para nombrar específicamente los lingotes del metal
que los romanos habían llamado argentum (por eso el símbolo Ag).
Sodio: El sodio fue descubierto en 1807 por el químico británico Humphry Davy.
La palabra sodio viene del árabe 'sauda' (una planta con alto contenido
en carbonato de sodio cuyas cenizas), el símbolo Na del latín 'natrium' y
éste del árabe 'natrun'.
platino: Su denominación proviene de la palabra española 'platina', diminutivo de plata.
Hierro: El hierro fue descubierto en la prehistoria y era utilizado como adorno y
para fabricar armas. Se conoce con el nombre de edad del hierro al
periodo en el que se comenzaron a utilizar utensilios y armas de este
metal. El símbolo Fe viene del latín ferrum.
Polonio: El polonio fue descubierto en 1898 por los esposos Curie mientras
realizaban investigaciones con la pechblenda y debe su nombre a Polonia,
país de nacimiento de Maria Sklodowska Curie. Es un metal blando, gris
plateado, peligroso por su elevada radioactividad.
Paladio: El paladio fue descubierto por químico británico William Hyde Wollaston
en 1803. Su nombre se deriva del asteroide Pallas, descubierto poco
tiempo antes. Es un metal sólido, dúctil, maleable y de color blanco. Es
el más blando y maleable de todos los metales del grupo del platino
jueves, 31 de octubre de 2013
jueves, 17 de octubre de 2013
LA TABLA PERIODICA
Definición y origen de la tabla periódica.
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elemento químicos conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos.Clasificación de los elementos.
Cada elemento químico contiene un enlace que explica sus propiedades químicas, efectos sobre la salud, efectos sobre el medio ambiente, datos de aplicación, fotografía y también información acerca de la historia y el descubridor de cada elemento.Grupos.
Grupo 2 (II A): los metales alcalinotérreos
Grupo 3 (III B): Familia del Escandio
Grupo 4 (IV B): Familia del Titanio
Grupo 5 (V B): Familia del Vanadio
Grupo 6 (VI B): Familia del Cromo
Grupo 7 (VII B): Familia del Manganeso
Grupo 8 (VIII B): Familia del Hierro
Grupo 9 (IX B): Familia del Cobalto
Grupo 10 (X B): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Grupo 13 (III A): los térreos
Grupo 14 (IV A): los carbonoides
Grupo 15 (V A): los nitrogenoides
Grupo 16 (VI A): los calcógenos o anfígenos
Grupo 17 (VII A): los halógenos
Grupo 18 (VIII A): los gases nobles
Propiedades.
| Principales propiedades periódicas | |
| Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos: | |
| - Estructura electrónica: distribución de los electrones en los orbitales del átomo | |
| - Potencial de ionización: energía necesaria para arrancarle un electrón. | |
| - Electronegatividad: mide la tendencia para atraer electrones. | |
| - Afinidad electrónica: energía liberada al captar un electrón. | |
| - Carácter metálico: define su comportamiento metálico o no metálico. | |
| - Valencia iónica: número de electrones que necesita ganar o perder para el octete. | |
| Otras propiedades periódicas |
|
| Podemos enumerar | |
| - Volumen atómico - Radio iónico - Radio atómico | |
| - Densidad - Calor específico - Calor de vaporización | |
| - Punto de ebullición - Punto de fusión - Valencia covalente | |
| - Carácter oxidante o
reductor |
jueves, 10 de octubre de 2013
ACCIDENTES COMUNES EN EL LABORATORIO
Accidentes en el laboratorio.
En
el laboratorio, nos exponemos a varios tipos de accidentes, ya sea en
la manipulación de sustancias peligrosas o en el trabajo con el mechero
de bunsen, es importante relacionarnos con los tipos de accidentes más
comunes y la manera correcta de actuar en un momento.
Quemaduras:
Causadas por calor seco (llama u objetos
calientes): en cado de quemaduras leves, aplicar pomada de picrato de busina.
En cambio si las quemaduras son graves, deben ser cubiertas con gasa
esterilizada humedecida con solución acuosa de bicarbonato de sodio al 5 %.
Causada por ácidos: lavar inmediatamente la
zona afectada con agua en abundancia, durante 5 minutos. Enseguida, lavar con
solución saturada de bicarbonato de sodio y nuevamente con agua. Secar, luego
aplicar un cicatrizante.
Causada por álcali: lavar la zona
inmediatamente con bastante agua, durante 5 minutos. Tratar con solución de ácido acético al 1 % y
nuevamente con agua. Secar la piel y aplicar cicatrizante.
Ácido en los ojos:
Ácido en los ojos:
Lavar los ojos con agua
durante 15 minutos y después aplicar solución de bicarbonato de sodiol.
Álcali en los ojos:
Álcali en los ojos:
Lavar los ojos con agua
durante 15 minutos y después aplicar solución de ácido bórico al 1 %.
Intoxicación por gases:
Intoxicación por gases:
Retirar a la víctima a un ambiente alejado, dejándolo descansar.
Ingestión de sustancias Tóxicas:
Ingestión de sustancias Tóxicas:
martes, 8 de octubre de 2013
PALABRAS QUE NO PUEDAS ENTENDER DE PRODUCTOS QUIMICOS
Estas son algunas palabras que puede que no entiendas.
- El comburente es cualquier sustancia que en ciertas condiciones de temperatura y presión puede combinarse con un combustible, provocando la combustión.
- Radiaciones ionizantes son aquellas radiaciones con energía suficiente para ionizar la materia, extrayendo los electrones de sus estados ligados al átomo. La ionización es el fenómenos químicos mediante el cual se producen iones, estos son átomo debido al exceso o falta deelectrones respecto a un átomo o molécula neutro.
- Una sustancia corrosiva es una sustancia que puede destruir o dañar irreversiblemente otra superficie o sustancia con la cual entra en contacto. Los principales peligros para las personas incluyen daño a los ojos, la piel y el tejido debajo de la piel; la inhalación oingestión de una sustancia corrosiva puede dañar las vías respiratorias y conductos gastrointestinales.
martes, 1 de octubre de 2013
NORMAS DE SEGURIDAD
- Utiliza una bata y tenla siempre bien abrochada, así protegerás tu ropa.
-
Guarda tus prendas de abrigo y los objetos personales en un armario o taquilla y no los dejes nunca sobre la mesa de trabajo.
-
No lleves bufandas, pañuelos largos ni prendas u objetos que dificulten tu movilidad.
-
Procura no andar de un lado para otro sin motivo y, sobre todo, no corras dentro del laboratorio.
-
Si tienes el cabello largo, recógetelo.
-
Dispón sobre la mesa sólo los libros y cuadernos que sean necesarios.
-
Ten siempre tus manos limpias y secas. Si tienes alguna herida, tápala.
-
No pruebes ni ingieras los productos.
-
En caso de producirse un accidente, quemadura o lesión, comunícalo inmediatamente al profesor.
-
Recuerda dónde está situado el botiquín.
-
Mantén el área de trabajo limpia y ordenada.
- Antes de manipular un aparato o montaje eléctrico, desconéctalo de la red eléctrica.
-
No pongas en funcionamiento un circuito eléctrico sin que el profesor haya revisado la instalación.
-
No utilices ninguna herramienta o máquina sin conocer su uso, funcionamiento y normas de seguridad específicas.
-
Maneja con especial cuidado el material frágil, por ejemplo, el vidrio.
-
Informa al profesor del material roto o averiado.
-
Fíjate en los signos de peligrosidad que aparecen en los frascos de los productos químicos.
-
Lávate las manos con jabón después de tocar cualquier producto químico.
-
Al acabar la práctica, limpia y ordena el material utilizado.
-
Si te salpicas accidentalmente, lava la zona afectada con agua abundante. Si salpicas la mesa, límpiala con agua y sécala después con un paño.
-
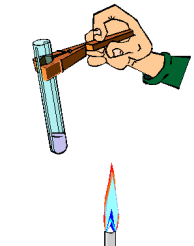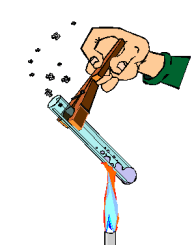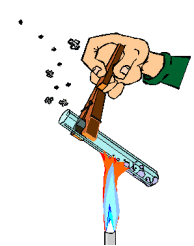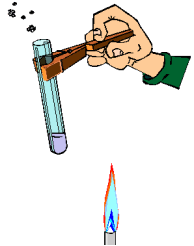
Evita el contacto con fuentes de calor. No manipules cerca de ellas sustancias inflamables. Para sujetar el instrumental de vidrio y retirarlo del fuego, utiliza pinzas de madera. Cuando calientes los tubos de ensayo con la ayuda de dichas pinzas, procura darles cierta inclinación. Nunca mires directamente al interior del tubo por su abertura ni dirijas esta hacia algún compañero. (ver imagen)
-
Todos los productos inflamables deben almacenarse en un lugar adecuado y separados de los ácidos, las bases y los reactivos oxidantes.
-
Los ácidos y las bases fuertes han de manejarse con mucha precaución, ya que la mayoría son corrosivos y, si caen sobre la piel o la ropa, pueden producir heridas y quemaduras importantes.
-
Si tienes que mezclar algún ácido (por ejemplo, ácido sulfúrico) con agua, añade el ácido sobre el agua, nunca al contrario, pues el ácido «saltaría» y podría provocarte quemaduras en la cara y los ojos.
-
No dejes destapados los frascos ni aspires su contenido. Muchas sustancias líquidas (alcohol, éter, cloroformo, amoníaco...) emiten vapores tóxicos.
Suscribirse a:
Entradas (Atom)





